STEP #04 - La scienza
Come già accennato (e come approfondiremo più avanti), il principio fisico maggiormente sfruttato nell'orologio atomico è la transizione tra stati iperfini di un isotopo del cesio alla temperatura di 0 assoluto. Questa definizione è comprensibile solo conoscendo la meccanica quantistica; infatti i principi elementari contenuti intrinsecamente in questa definizione sono due:
- La natura discreta dell'energia: a differenza di quanto si pensava fino agli ultimi anni del diciannovesimo secolo, l'energia, così come tutte le grandezze fisiche, non ha una natura continua, cioè non si possono misurare sperimentalmente tutti i valori di energia; essa ha infatti una natura granulare, per cui si hanno dei "pacchetti" di energia, e un corpo può contenere solo multipli di essi
- Legge di Planck: l'energia di una particella è direttamente proporzonale alla sua frequenza (matematicamente: E = h ν)
Vediamo brevemente la storia delle origini della meccanica quantistica. Il primo a ipotizzare la natura discreta dell'energia fu Max Planck nel 1900 (anche se già Ludwig Boltzmann ne aveva fatto accenno nel 1877), ma egli stesso non riuscì a capire cosa volesse dire la formula a cui era arrivato. Infatti la sua legge fu formulata ad hoc con il solo scopo di avere un modello matematico che spiegasse i grafici di radiazione del corpo nero.
Cinque anni dopo, durante il suo annus mirabilis, Albert Einstein suggerì che la radiazione elettromagnetica esiste in forma di pacchetti chiamati fotoni. Questa ipotesi gli permise di sciogliere il nodo gordiano dell'effetto fotoelettrico, fino ad allora rimasto un paradosso in quanto l'emissione di elettroni da parte di un metallo colpito da luce non dipendeva dall'intensità di questultima, ma solo dalla sua frequenza.
L'ipotesi di Planck permise a Niels Bohr di formulare un modello matematico dell'atomo di idrogeno, che viene tutt'ora considerato una buona approssimazione della realtà.
Nel 1924 venne teorizzata da Louis de Broglie l'equivalenza fra onda e particella, che rappresenta una delle colonne portanti di tutta la teoria quantistica.
L'anno successivo Erwin Schrödinger formulò quella che è l'equazione più importante in tutta la fisica moderna, chiamata appunto equazione di Schrödinger (in figura). Essa descrive infatti l'evoluzione temporale di una funzione d'onda, e quindi di una qualsiasi particella.
In quegli anni Wolfgang Pauli spiegò teoricamente la struttura iperfine degli atomi, gettando inconsapevolmente le basi per la costruzione degli attuali orologi atomici.
Fonte:
Bibliografia:
D. Ter Haar. The Old Quantum Theory, Pergamon, 1967
C. Piron. Foundations of Quantum Physics, W. A. Benjamin, 1976
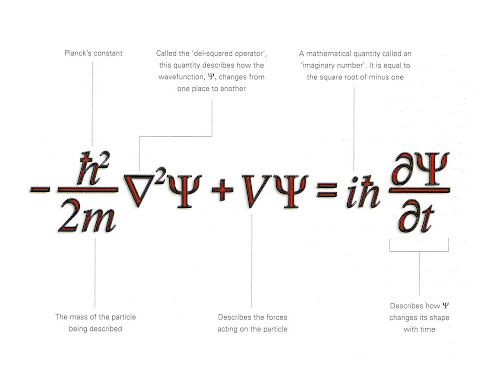
Commenti
Posta un commento